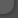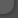|
Патология олигодендроглии и миелинизированных аксонов в гиппокампе при шизофрении (ультраструктурно-морфометрическое исследование)
Н. С. Коломеец Н. А. Уранова
Провели изучение ультраструктуры олигодендроглии и миелинизированных волокон, а также количественную оценку численной плотности и пропорции патологически измененных миелинизированных волокон в СА3 области гиппокампа в 25 случаях без психической патологии и 25 случаях шизофрении. Выявлены дистрофические изменения олигодендроглиоцитов, а также атрофия части миелинизированных волокон. Выраженность патологии была связана с возрастом пациентов к периоду начала заболевания и с реактивностью микроглии. Последнее указывает на роль иммунных факторов в патогенезе выявленных нарушений.
Известно, что функционирование головного мозга, обеспечивающее протекание процессов высшей нервной деятельности и их психических проявлений, определяется состоянием межнейронных связей, отростков нейронов и синаптических контактов. Клиническая феноменология шизофрении (разной степени выраженности патология мышления, наличие бредовых идей и др.) дает основание предполагать возможность нарушения синаптических связей в мозге. Это находит подтверждение, в частности, в результатах исследований 24, 49, свидетельствующих о нарушениях межнейронных связей в гиппокампе при шизофрении.
В связи со сказанным важно подчеркнуть, что миелиновые оболочки аксонов играют важную роль в регуляции синаптических функций, поскольку они регулируют скорость проведения нервных импульсов по нервным волокнам и их синхронизацию, обеспечивая тем самым адекватную синаптическую пластичность 34. Известно, что олигодендроциты (ОЛГ) являются основными миелинобразующими клетками мозга, а также играют важную роль в трофической поддержке нейронов 12, что делает необходимым изучение состояния перечисленных структур мозговой ткани при шизофрении.
Повышение интереса к роли патологии ОЛГ и миелина в патогенезе шизофрении в последнее десятилетие связанно с развитием прижизненных морфофункциональных исследований (МРТ, диффузионная тензорная томография), которые позволили выявить не только атрофию белого и серого вещества мозга при шизофрении 15, но также изменения в структуре миелиновых трактов 29. Чувствительность этих методов на настоящий момент такова, что стало возможным изучение особенностей отдельных трактов. Благодаря этому были установлены уменьшение размеров и снижение анизотропии свода мозга, в котором проходит большинство волокон, соединяющих гиппокамп с другими областями мозга, в том числе и с фронтальной корой 13, 30. Как показано в недавних исследованиях, динамика миелинизации мозга в онтогенезе тесно связана с развитием когнитивных функций 18, 42. Интенсивная миелинизация ключевых областей височной доли мозга, включая гиппокамп, приходится на вторую-третью декаду постнатальной жизни, т.е. период наиболее вероятной манифестации симптомов шизофрении и продолжается в зрелом мозге 8. В связи с этим необходимо напомнить, что гиппокамп играет существенную роль в когнитивных процессах, в том числе в их нарушениях при шизофрении 37.
Не менее важную роль сыграло развитие методов нейроморфологических исследований, в особенности стереологической морфометрии, что позволило подтвердить выраженный дефицит числа ОЛГ в префронтальных областях коры головного мозга при шизофрении 27, 48. При ультраструктурных исследованиях были выявлены выраженные дегенеративные изменения ОЛГ и патология миелиновых оболочек аксонов в префронтальной и зрительной коре, а также в хвостатом ядре мозга пациентов 46, 47. Эти данные свидетельствуют о широком распространении патологии ОЛГ и миелинизированных аксонов (МА) в сером веществе мозга при шизофрении и ее важной роли в патогенезе заболевания.
О высокой вероятности патологии ОЛГ и МА в гиппокампе при шизофрении свидетельствует снижение в нем экспрессии широкого спектра генов, от которых зависит функционирование ОЛГ, структура миелина, а также синтез адгезивных молекул, обеспечивающих аксоно-глиальные взаимодействия 16, 28.
Кроме того, при прижизненной визуализации структур мозга было выявлено уменьшение объема гиппокампа при шизофрении 36. Описано также снижение размеров пирамидных нейронов и их дендритного дерева 6, 51 в гиппокампе при этом заболевании.
Приведенные данные указывают на возможное нарушение трофических функций ОЛГ в гиппокампе при шизофрении. Большинство этих изменений, как и нарушения глутаматергической нейромедиации, характерные для гиппокампа при шизофрении, наиболее выражены в СА3 области гиппокампа 24, 31, 49. Этот факт дает основание предположить, что токсические эффекты глутамата могут быть одним из факторов, вызывающих дегенерацию и гибель ОЛГ 45. Тем не менее ОЛГ и МА в гиппокампе при шизофрении практически не изучены.
Целью настоящего исследования было изучение ультраструктуры ОЛГ и МА в СА3 области гиппокампа мозга больных шизофренией, а также количественная оценка численной плотности и пропорции патологически измененных миелинизированных волокон.
Материал и методы
Образцы гиппокампа были взяты из коллекции лаборатории клинической нейроморфологии Научного центра психического здоровья РАМН, которая была составлена на основе аутопсий, проводившихся в патологоанатомических отделениях Московских психиатрических больниц №1 и №15 и судебно-медицинского морга №2. Все образцы мозга предварительно были подвергнуты нейрогистологическому исследованию для исключения признаков болезни Альцгеймера, паркинсонизма, сосудистых и других органических заболеваний.
Была изучена ткань гиппокампа из левого полушария мозга в 25 случаях без психической патологии (5 женщин и 20 мужчин) и 25 случаях шизофрении (12 женщин и 13 мужчин). Диагностику шизофрении при жизни больных проводили по МКБ-10. В 18 случаях диагностирована параноидная шизофрения, в том числе 13 — с непрерывным типом течения (рубрика F20.00) и 5 — с приступообразно-прогредиентным течением (F20.01); в 3 случаях — кататоническая шизофрения (F20.21); в 2 случаях — недифференцированная шизофрения (F20.30 и F20.31); в 1 — гебефреническая шизофрения (F20.10) и в 1 — неуточненная форма (F20.98). Продолжительность болезни составляла 28,16±12,21 года и варьировала от 4 до 49 лет. Более подробно характеристика изученных наблюдений представлена в табл. 1.
|
Таблица 1. Характеристика основной и контрольной групп наблюдений
| |

| |
Примечание. Постмортальный интервал — период времени от момента смерти до взятия материала для исследования; количественные данные в таблице представлены как М±SD.
|
Для целей клинико-анатомического анализа были также выделены определенные клинические признаки, позволившие разделить случаи шизофрении на соответствующие подгруппы сравнения и допускавшие количественную оценку различий между ними. В табл. 2 они представлены в виде подгрупп 1 и 2 по таким признакам, как возраст пациентов к периоду начала психоза, длительность болезни, тип течения болезни, преобладание негативных и позитивных симптомов во время последней госпитализации (к периоду наступления летального исхода). Оценка преобладающей симптоматики проводилась по шкалам SANS и SAPS ретроспективно 5. В каждом случае определяли суммарный показатель, отражающий наличие позитивных или негативных симптомов, а также их тяжесть (высокая, средняя или низкая). Преобладание позитивных или негативных симптомов определяли на основании соотношения суммарных показателей для позитивных и негативных симптомов.
|
Таблица 2. Выделенные для целей клинико-анатомического анализа подгруппы случаев шизофрении
| |

| |
Примечание. Больных с возрастом начала заболевания между 23 и 28 годами в выборке не было.
|
Кроме того, оценивали интенсивность нейролептической терапии, которая выражалась в хлорпромазиновом эквиваленте 14.
Для проведения ультраструктурного исследования кусочки ткани гиппокампа фиксировали погружением в смесь 3% глутарового альдегида и 4% параформальдегида в 0,1 М фосфатном буфере (рН=7,4) в течение 1 недели. Из фиксированной ткани иссекали маленькие кусочки, содержащие материал СА3 области гиппокампа 10, промывали их в 0,1М фосфатном буфере (рН=7,4), обезвоживали в спиртовых растворах восходящей концентрации, осмировали в 1% водном растворе осмия и заключали в Аралдит. Полутонкие срезы (1 мкм), окрашенные метиленовым синим, использовали для окончательной идентификации СА3 области и заточки пирамид для ультратонкой резки. Два блока ткани для каждого случая затачивали в виде маленьких пирамид (0,5—1 мм2), содержащих материал пирамидного слоя СА3 области гиппокампа. Ультратонкие срезы собирали на медные бленды, покрытые подложкой из формвара и стабилизированные углеродным напылением. Ультратонкие срезы окрашивали последовательно водным раствором уранилацетата и раствором цитрата свинца и исследовали с помощью электронного микроскопа Philips-420 (Голландия).
ОЛГ идентифицировали благодаря небольшим (относительно нейронов и астроцитов) размерам, округлой четко очерченной цитоплазме и наличию круглого или овального ядра с плотным ободком конденсированного хроматина вдоль ядерной оболочки. Дополнительным критерием служило отсутствие гликогена и глиофиламент в цитоплазме 39.
Для морфометрического исследования численной плотности МА по 36 участков нейропиля пирамидного слоя СА3 области гиппокампа для каждого из двух блоков снимали случайным образом при увеличении x3800. Негативы микрофотографий увеличивали в 8 раз (конечное увеличение x30 500) и подсчитывали общее число МА, а также число МА с патологически измененными миелиновыми оболочками. Критерии для выделения различных типов патологических изменений МА подробно описаны в разделе «Результаты».
Численная плотность МА (Na МА) определялась в соответствии с формулой:
Na МА=SN МА?S, где N МА — число МА на негатив, S — площадь негатива.
Общая площадь анализа составила 24 768 мкм2 на случай. Пропорцию МА с патологическими изменениями миелиновой оболочки каждого типа определяли как частное от деления Na МА соответствующего типа к Na МА в целом.
Статистический анализ. Нормальность распределения для исследуемых параметров в группах сравнения тестировали с использованием критерия Колмогорова—Смирнова (для всех исследованных параметров р>0,2). Групповые коэффициенты ошибки (отношение стандартной ошибки среднего к среднему по подгруппе) в группах сравнения варьировали от 0,04 до 0,09.
Для сравнения численной плотности МА, а также пропорций патологически измененных МА, использовали непараметрические методы, поскольку Levene-тест выявил негомогенность дисперсий в группах сравнения (для всех параметров р<0,05).
Для сравнения среднего возраста и посмертного интервала (ПМИ) между группами сравнения использовали однофакторный дисперсионный анализ. Возможное влияние возраста и ПМИ на исследуемые параметры тестировали также с помощью корреляционного анализа Спирмена. Корреляционный анализ использовали также для выявления возможных взаимосвязей между исследуемыми параметрами и продолжительностью заболевания, возрастом пациентов к периоду начала заболевания, интенсивностью нейролептической терапии.
Результаты
Олигодендроглиоциты
При электронной микроскопии была выявлена хорошая сохранность ультраструктуры ОЛГ как в контрольных случаях, так и в случаях шизофрении (рис. 1).
|
Рисунок 1. Ультраструктура олигодендроглиоцитов (ОЛГ) в пирамидном слое СА3 области гиппокампа из мозга контрольных случаев (а) и случаев шизофрении (б — г). Набухание цитоплазмы и органелл в ОЛГ, контактирующем микроглиальной клеткой (МК), шизофрения (б). Дегенерация ОЛГ при шизофрении: (в) некроз и (г) апоптоз (звездочка).
| |

| |
Примечание. Масштаб 2 мкм.
|
В контрольных случаях для этих клеток были характерны круглые или овальные ядра с узким слоем конденсированного хроматина вдоль ядерной оболочки и единичными глыбками в кариоплазме (см. рис.1, а). Размеры цитоплазмы были невелики, ее четко очерченные контуры повторяли форму ядра. Немногочисленные органеллы были представлены цистернами шероховатого эндоплазматического ретикулума, свободными рибосомами и митохондриями, иногда присутствовали несколько параллельных цистерн аппарата Гольджи. Часть ОЛГ в контроле характеризовались небольшим набуханием цитоплазмы, а также канальцев ретикулума и митохондрий, тогда как ультраструктура ядер и степень конденсации хроматина не претерпевали видимых изменений. Описанные изменения ультраструктуры ОЛГ можно рассматривать как реактивные, связанные с фазой функционирования клетки или со стадией ее жизненного цикла. Полуколичественный анализ показал, что число таких ОЛГ в контрольных случаях составляло максимум 20% в пределах исследованной площади пирамидного слоя. В случаях шизофрении число таких ОЛГ несколько выше и достигает 40%. Кроме того, при шизофрении в таких ОЛГ чаще присутствуют цитоплазматические включения в виде конгломератов крупных электронноплотных гранул, иногда в комбинации с липидными каплями или липофусциноподобными гранулами.
Описанные особенности ультраструктуры ОЛГ характерны и для части этих клеток в пирамидном слое СА3 области гиппокампа в случаях шизофрении. Однако в случаях шизофрении были выявлены также выраженные дистрофические изменения ОЛГ, редко встречавшиеся в контроле. Так, для существенной части ОЛГ при шизофрении была характерна эктопия и уменьшение размеров ядер, которые содержали многочисленные глыбки конденсированного хроматина в кариоплазме, а также набухание и увеличение размеров цитоплазмы (см. рис. 1, б). В цитоплазме таких ОЛГ практически отсутствовали митохондрии и рибосомы, органеллы были представлены лишь вакуолеобразно расширенными цистернами эндоплазматического ретикулума. Характерны крупные цитоплазматические включения в виде конгломератов электронноплотного материала, часто в ассоциации с липофусциноподобными гранулами. Особенностью части случаев шизофрении были цитоплазматические включения, заполняющие большую часть цитоплазмы в виде огромных монолитных капель и напоминающие по своей электронной плотности липофусциновые гранулы. Такие включения никогда не встречались в ОЛГ гиппокампа контрольных случаев.
Крайняя степень развития дистрофических изменений ОЛГ характеризовалась пикнозом ядра, нарушением целостности ядерной оболочки, резким набуханием цитоплазмы, отсутствием органелл, что соответствует некрозу (см. рис. 1, в). Пропорция ОЛГ такого типа в случаях шизофрении невелика, хотя и заметно выше, чем в контроле, где они практически не встречались. Часто изменения ультраструктуры такого типа присутствовали в ОЛГ, тесно контактирующих с микроглиальными клетками.
Другой тип дегенеративных изменений ультраструктуры ОЛГ пирамидного слоя гиппокампа при шизофрении характеризовался выраженной агрегацией конденсированного хроматина и пикнозом ядер (см. рис. 1, г). Цитоплазма таких клеток становилась электронноплотной, ее размеры существенно уменьшались, однако в ней присутствовали рибосомы и единичные митохондрии. Крайняя степень выраженности таких изменений с ядром, полностью заполненным конденсированным хроматином, соответствует апоптозу. Часто такие ОЛГ были инкорпорированы в отростки или тело астроцита. Апоптоз ОЛГ практически не наблюдался в контрольных случаях и редко — в случаях шизофрении. Практически такие изменения характерны для двух случаев шизофрении, которые характеризовались ранним началом заболевания (15—16 лет), относительно молодым возрастом (34 года и 46 лет), длительностью болезни более 19 лет и преобладанием негативной симптоматики в клинической картине заболевания.
Хотя выраженность изменений ультраструктуры ОЛГ в пирамидном слое СА3 области гиппокампа при шизофрении существенно варьировала от случая к случаю, полуколичественный позволил установить, что пропорция ОЛГ с дегенеративными изменениями не зависела от типа течения заболевания, его продолжительности и преобладания негативной или позитивной симптоматики в картине заболевания и составляла в среднем 15% от общего количества ОЛГ на случай. Можно лишь заметить, что соответствующие изменения были более выражены у пациентов старшего возраста с поздним началом заболевания (до 30% всех ОЛГ).
Миелинизированные аксоны
Качественный анализ ультраструктуры МА в пирамидном слое СА3 области гиппокампа показал, что наряду с множеством МА с хорошей сохранностью ультраструктуры миелиновых оболочек (рис. 2, а), как в контроле, так и при шизофрении встречаются три основных типа (изменений) повреждений миелиновой оболочки.
|
Рисунок 2. Ультраструктура миелинизированных аксонов (МА) в пирамидном слое СА3 области гиппокампа из мозга контрольных случаев (а) и случаев шизофрении (б — в).
| |

| |
Примечание. Патология МА при шизофрении: б — выпячивание части миелиновой оболочки внутрь волокна (светлая *) и погружение части миелиновой оболочки в прилежащий астроцитарный отросток (стрелка); в — набухание периаксонального отростка ОЛГ (**) и атрофия аксона (стрелка). Масштаб 1 мкм.
|
Для части МА было характерно локальное выпячивание наружной части миелиновой оболочки, иногда сопровождающееся увеличением промежутка между ламеллами на этом участке и снижением их электронной плотности (см. рис. 2, б, патология 1-го типа). В этом случае характерной особенностью является наличие астроцитарного отростка, тесно прилежащего к МА в месте отслоения ламелл миелина, причем последние оказываются полностью погруженными в астроцитарный отросток.
В другой части МА наблюдалось «грыжеподобное» выпячивание части миелиновой оболочки внутрь миелинизированного отростка (см. рис. 2, б, патология 2-го типа). Такие участки обычно были довольно крупными, состояли из многочисленных плотноупакованных ламелл миелина и сохраняли связь с миелиновой оболочкой МА.
Изменения 3-го типа (атрофия аксона) характеризовались набуханием периаксиального глиального отростка, резком уменьшении диаметра аксона и смещении его от центра волокна к миелиновой оболочке (см. рис. 2, в, патология 3-го типа). Часто в таких случаях миелиновая оболочка была очень тонкой и состояла всего из нескольких ламелл.
Изменения ультраструктуры МА 1-го и 2-го типа встречались как в случаях шизофрении, так и в контроле, третий тип изменений ультраструктуры МА часто встречался в случаях шизофрении, а также примерно в половине контрольных случаев.
При количественном анализе не было выявлено различий между контролем и шизофренией по общей численной плотности МА, а также по численной плотности и пропорции МА с патологией миелиновых оболочек 1-го и 2-го типа (для всех параметров p?0,13, U тест Манна—Уитни).
Численная плотность и пропорция МА с патологией 3-го типа была достоверно выше в случаях шизофрении по сравнению с контролем (соответственно: в 2 раза, р=0,003; на 140%, р=0,0014).
Сравнение подгрупп случаев шизофрении, разделенных в зависимости от возраста больных к периоду начала заболевания (см. табл. 2), показало, что достоверное увеличение численной плотности и пропорции атрофичных МА по сравнению с контролем наблюдается только в подгруппе пациентов с началом заболевания в зрелом возрасте (после 28 лет) (ANOVA Крускала—Уоллиса, для всех параметров р?0,01), тогда как случаи с ранним началом (до 23 лет) заболевания не отличались по этим параметрам от контроля (рис. 3). Не выявлено различий по указанным параметрам между подгруппами случаев шизофрении, разделенными в зависимости от длительности заболевания, типа его течения, а также преобладания позитивной или негативной симптоматики (см. табл. 2), хотя все подгруппы достоверно отличались по этим показателям от контроля. Не было обнаружено достоверных корреляций численной плотности МА, а также численной плотности и пропорций МА с патологией 1, 2 и 3-го типов с длительностью болезни или возрастом больных к периоду начала заболевания (для всех параметров R?1,35, р?0,18, корреляция Спирмена).
|
Рисунок 3. Индивидуальные значения численной плотности (Na) атрофичных миелинизированных аксонов в контроле (треугольники) и при шизофрении: в подгруппе случаев с началом заболевания до 23 лет (белые круги) и в подгруппе с началом заболевания после 28 лет (серые круги).
| |

| |
Примечание. Горизонтальные линии в каждой группе — средние.
|
Анализ факторов возможного влияния на исследуемые параметры
Не обнаружено различий по среднему возрасту (М±s: 54,84±15,7 года в контрольной группе, 56,52±18,1 года в группе шизофрении) или среднему постмортальному интервалу (5,9±0,88 ч в контрольной группе, 6,3±1,4 ч в группе шизофрении) между случаями шизофрении и контролем (1 факторная ANOVA, для всех параметров p?0,67). Численная плотность и пропорции измененных МА не различались достоверно между мужчинами и женщинами (для всех параметров рі0,08).
При корреляционном анализе не выявлено связи возраста и длительности постмортального интервала с численной плотностью МА, а также с численной плотностью и пропорциями патологически измененных МА (для всех сравнений R?2,33, p?0,3, корреляция Спирмена). Исследованные параметры не коррелировали с хлорпромазиновым эквивалентом.
Обсуждение
Проведенное исследование позволило выявить изменения ультраструктуры ОЛГ в пирамидном слое СА3 области гиппокампа при шизофрении. Описаны признаки дистрофических и дегенеративных изменений (вплоть до некроза и апоптоза), изменений ультраструктуры ОЛГ. Кроме того, выявлено достоверное увеличение числа патологически измененных МА, которые характеризовались набуханием периаксиального глиального отростка и существенным уменьшением диаметра аксона, что свидетельствует об атрофии части МА в пирамидном слое гиппокампа при шизофрении.
Следует отметить, что указанные выше изменения ультраструктуры ОЛГ наблюдались на фоне хорошей сохранности ультраструктуры нейронов и нейропиля, которые, как известно, особенно чувствительны к процессам посмертных изменений мозга 4. Атрофичные МА были выявлены среди множества волокон с сохранной ультраструктурой и их численная плотность не коррелировала с длительностью постмортального интервала.
Хотя по данным качественных исследований изменения миелиновых оболочек аксонов, подобные описанным в настоящем исследовании, часто встречаются в мозге приматов при старении 40, при проведенном нами количественном анализе не было выявлено зависимости показателей ни одного из описанных типов изменений МА от возраста пациентов ни в контрольной группе, ни при шизофрении. Пол пациентов также не оказывал влияния на численную плотность атрофичных МА. В литературе имеются данные о том, что иммунореактивность, связанная с основным белком миелина, выше в некоторых областях гиппокампа у здоровых женщин и только у женщин снижается при шизофрении 11. Однако в настоящем исследовании, где был рассмотрен особый тип патологии МА, связанный как с атрофией миелиновой оболочки, так и самого аксона, зависимости изменений от пола обнаружено не было. Не было также корреляций численной плотности и пропорции атрофичных МА с хлорпромазиновым эквивалентом при шизофрении. Но была обнаружена достоверная связь выраженности патологии МА с возрастом пациентов к периоду начала заболевания. Сказанное позволяет сделать вывод о том, что выявленные изменения ультраструктуры ОЛГ и части МА в пирамидном слое СА3 области гиппокампа при шизофрении связаны с болезнью. Такой вывод подтверждается и данными масштабного сравнительного исследования, установившего, что при шизофрении гиппокамп является одной из структур с наиболее выраженными изменениями экспрессии белков, от которых зависит дифференцировка и функционирование ОЛГ, а также адгезивных молекул, обеспечивающих аксоно-глиальные взаимодействия 28. Кроме того, следует подчеркнуть, что аналогичные изменения ультраструктуры ОЛГ и МА были описаны ранее в префронтальной и зрительной коре, а также в хвостатом ядре мозга при шизофрении 47. Патология миелиновых оболочек аксонов, обнаруженная в биопсийном материале 35 и аутопсийном мозге 43, свидетельствует о широком распространении патологии ОЛГ и МА в сером веществе мозга при шизофрении. Если принять во внимание чувствительность ОЛГ к таким повреждающим факторам, как нарушения обмена глутамата или воздействие инфекционных агентов, то патологию ОЛГ можно считать одним из важных факторов патогенеза шизофрении.
Следует подчеркнуть, по нашим данным выраженная патология ОЛГ и МА имелась в гиппокампе пациентов с разным типом течения заболевания, с различной длительностью заболевания, у больных с преобладанием как позитивной, так и негативной симптоматики. В этом смысле можно говорить о своего рода универсальном характере выявленной патологии, что также свидетельствует, что она является важным патогенетическим звеном шизофрении.
Значение изменений структуры ОЛГ и МА в патогенезе заболевания определяется тесной связью ОЛГ и процессов миелинизации с осуществлением высшей нервной деятельности 18, 34. Как уже говорилось выше, становление когнитивных функций в постнатальном онтогенезе человека тесно связано с образованием миелина 18, 42. При этом пик миелинизации областей гиппокампа, ключевых для образования гиппокампо-префронтальных связей, приходится на вторую декаду постнатальной жизни, т.е. период вероятной манифестации симптомов шизофрении 8. К тому же, описанные нарушения ультраструктуры ОЛГ в совокупности с данными об атрофии пирамидных нейронов и их дендритного дерева в гиппокампе при шизофрении 6, 51, а также о подавлении экспрессии в этой структуре ряда нейротрофических факторов (BDNF, фактор роста нервов, нейрорегулин) 26, синтез которых в значительной мере связан с олигоцитами 12, служат существенным подтверждением нарушений трофических функций ОЛГ в гиппокампе при шизофрении.
Точно определить происхождение атрофичных МА в данном случае невозможно. Известно, что в гиппокампе человека миелинизированные волокна «endfolial» пучка пересекают пирамидный слой СА3 области 33 и в мозге человека этот путь содержит аксоны пирамидных клеток пирамидных нейронов СА3 области и хилуса, и является частью системы Шафферовских коллатералей. Хотя описано уменьшение размеров СА3 пирамидных нейронов гиппокампа и существенная редукция их дендритного дерева при шизофрении, данные об изменениях их аксонов в литературе отсутствуют. Тем не менее следует принимать во внимание, что объем отростков тесно связан с размерами тела нейрона 17. Поскольку, по мнению большинства авторов, в гиппокампе при шизофрении отсутствуют дегенеративные изменения, уменьшение размеров его нейронов и отростков расценивается часто как свидетельство дизонтогенеза. В любом случае, атрофия или гипотрофия части МА «endfolial» пучка пути может означать повреждение важнейшей части трисинаптического пути, который, будучи основным ассоциативным путем гиппокампа, соединяет воедино все его элементы.
Наши данные свидетельствуют, что тяжелые поражения МА характерны преимущественно для пациентов с началом заболевания в зрелом возрасте (после 28 лет). Хотя однозначно интерпретировать эти данные трудно, они находят некоторое подтверждение в данных прижизненных исследований. Было установлено, что у пациентов юношеского возраста с недавним началом заболевания отсутствует характерное для вновь заболевших пациентов зрелого возраста уменьшение размеров свода, в котором проходят основные пути, связывающие гиппокамп с ассоциативной корой 13, т.е. патология миелиновых волокон может зависеть от возраста пациентов к периоду начала заболевания.
Одной из возможных причин патологии ОЛГ могут быть изменения иммунного статуса пациентов, неоднократно описанные при шизофрении 3. Показаны высокая чувствительность ОЛГ к повреждающему действию цитокинов (фактор некроза опухолей, лимфотоксин), а также инфекционным агентам, включая вирусные 38. Следует подчеркнуть, что такой важный показатель сдвига иммунного статуса у больных шизофренией, как снижение уровня продукции интерлейкина-2 лимфоцитами, по данным некоторых авторов, отрицательно коррелировал с возрастом начала заболевания 21. По имеющимся данным это снижение тесно связано с продукцией противомозговых антител, в том числе к антигенам гиппокампа 20, 50. В пользу вероятной связи выявленной патологии с иммунным статусом пациентов свидетельствуют и полученные нами ранее данные о том, что выраженность патологии МА и ОЛГ тесно связана с особенностями реактивности микроглии 1.
Отмеченная связь возраста пациентов к периоду начала заболевания с выраженностью патологии ОЛГ и МА не столь однозначна, если рассмотреть ее более подробно. Так, тяжелые изменения ОЛГ по типу апоптоза выявлены нами в двух случаях шизофрении, характеризующихся ранним началом заболевания (15—16 лет), относительно молодым возрастом (34 года и 46 лет) и преобладанием негативной симптоматики в клинической картине заболевания. Возможно, эта особенность отчасти объясняется тем, что для такого важного показателя изменения иммунного статуса пациентов, как снижение продукции интерлейкина-2 лимфоцитами пациентов, выявлены не только отрицательные корреляции с возрастом начала заболевания, но и положительные — с тяжестью негативной симптоматики 20, 21. Кроме того, один из случаев шизофрении с ранним началом заболевания продемонстрировал, как видно на рис. 3, аномально высокую численную плотность атрофичных МА, превышающую по значению все остальные наблюдения. Это был случай кататонической шизофрении (F20.21) у больного 19 лет (самого молодого в нашей выборке). Он характеризовался минимальной длительностью заболевания (4 года), тогда как средняя длительность заболевания составляла 28,2±12,2 года.
Таким образом, по-видимому, существует достаточно сложная связь между особенностями патологии миелинобразующих ОЛГ и миелина, возрастом пациентов к началу заболевания и особенностями их иммунного статуса.
Возможная роль нарушений глутаматергической нейромедиации в патологии ОЛГ в гиппокампе при шизофрении определяется тем, что ОЛГ экспрессируют функционально активные рецепторы глутамата 19. Показано, что каинат в концентрациях, способных активировать каинат-селективные рецепторы, вызывает гибель ОЛГ in situ и in vivo 45 и токсические эффекты глутамата на ОЛГ опосредуются избыточным поступлением ионов кальция в клетку через глутаматные рецепторы 41. Такое предположение тем более вероятно, что нарушения обмена глутамата в гиппокампе при шизофрении наиболее выражены именно в СА3 области 24, 31, 49.
Что касается причинно-следственных связей между патологией ОЛГ и МА, известно, что сохранность аксонов является важным олигопротекторным фактором, а их повреждение приводит к дегенерации ОЛГ и снижению числа клеток в областях соответствующих ретроградных проекций 7. С другой стороны, нарушения функций миелина способны индуцировать грубые нарушения цитоскелета нейронов, приводящие к дегенерации аксонов 22. Как возможный медиатор взаимодействия аксонов с олигоцитами некоторые авторы рассматривают нейрорегулин, экспрессия которого в гиппокампе при шизофрении подавлена 32.
Важно отметить, что выраженность нарушений ультраструктуры ОЛГ, также как и численная плотность атрофичных МА, в гиппокампе ниже, чем в других областях мозга этих же пациентов 46, 47. К тому же при иммуногистохимическом исследовании миелинизации и численной плотности ОЛГ в гиппокампе при шизофрении было выявлено небольшое снижение иммунореактивности к основному белку миелина только в некоторых областях гиппокампа у пациентов—женщин, при этом число иммунореактивных ОЛГ не изменялось 11. Однако следует учитывать, что по некоторым данным уровень экспрессии гена основного белка миелина не изменялся в гиппокампе при шизофрении в отличие от множества других маркеров 16, что не может не сказываться на результатах приведенных иммуногистохимических исследований. Более того, по данным этих авторов, подавление экспрессии генов белков—маркеров ОЛГ и миелина в гиппокампе чаще всего не сопровождается снижением содержания соответствующих белков, что может указывать на существование мощных компенсаторных механизмов в этой функционально значимой структуре мозга 16.
Поскольку ранее нами был обнаружен локальный астроглиоз только в пирамидном слое СА3 области гиппокампа 2 (но не в других структурах мозга этих же пациентов), астроциты могут быть рассмотрены как потенциальный аксоно- и олигопротекторный фактор. Действительно, имеются данные, что астроциты способны взаимодействовать как со зрелыми ОЛГ, стимулируя процессы миелинизации в ответ на обучение или действие обогащенной среды 23, так и регулируют миелинизацию, дифференцировку и выживание ОЛГ и их предшественников в развивающемся мозге 44. В условиях патологии протекторное действие астроцитов основано прежде всего на их способности регулировать уровень внеклеточного глутамата 25. Кроме того, будучи иммунокомпетентными клетками, астроциты отвечают за сохранение иммунопривилегированного статуса мозга 9. Так, показано, что в ответ на воздействие провоспалительных цитокинов, образующихся в мозге при нейроиммунных нарушениях, астроциты способны отвечать синтезом ИЛ-11, обладающим отчетливым олигопротекторным действием 52.
Таким образом, в пирамидном слое СА3 области гиппокампа наблюдаются выраженные изменения ультраструктуры ОЛГ, а также атрофия части МА. Выраженность патологии ОЛГ и МА связана с возрастом пациентов к периоду начала заболевания, что указывает на вероятную роль онтогенетических особенностей организма, особенно в отношении процессов миелинизации в головном мозге, в патогенезе выявленных нарушений.
Литература
- Коломеец Н.С. Атрофия миелинизированных аксонов и ультраструктура микроглиальных клеток в гиппокампе при шизофрении. Российская конференция «Взаимодействие науки и практики в современной психиатрии», 9—11 октября 2007: Тезисы докладов.М 2007; 336—337.
- Коломеец Н.С. Астроцитарная глия гиппокампа при шизофрении. Журн неврол и психиат 2008.
- Коляскина Г.И., Секирина Т.П., Андросова Л.В. и др. Изменение иммунного профиля больных шизофренией в процессе лечения. Журн неврол и психиат 2004; 4: 39—45.
- Савулев Ю.И., Агафонов В.А. Ультраструктурные характеристики изменений нервных клеток в коре мозга и гипоталамусе в различные периоды после смерти. Журн невропатол и психиат 1977; 77: 1069—1074.
- Andreasen N.C., Olsen S. Negative vs. positive schizophrenia: definition and validation. Arch Gen Psychiat 1982; 39: 789—794.
- Arnold S.E., Franz B.R., Gur R.C. et al. Smaller neuron size in schizophrenia in hippocampal subfields that mediate cortical-hippocampal interactions. Am J Psychiat 1995; 152: 738—748.
- Barres B.A., Martin C., Raff M.C. Axonal control of oligodendrocyte development. J Cell Biol 1999; 147: 1123—1128.
- Benes F.M., Turtle M., Khan Y. et al. Myelination of a key relay zone in the hippocampal formation occurs in the human brain during childhood, adolescence, and adulthood. Arch Gen Psychiat 1994; 51: 477—484.
- Bsibsi M., Persoon-Deen C., Verwer R.W. et al. Toll-like receptor 3 on adult human astrocytes triggers production of neuroprotective mediators. Glia 2006; 53: 688—695.
- Cassell M.D., Brown M.W. The distribution of Timm’s stain in the nonsulfide-perfused human hippocampal formation. J Comp Neurol 1984; 222: 461—471.
- Chambers J.S., Perrone-Bizzozero N.I. Altered myelination of the hippocampal formation in subjects with schizophrenia and bipolar disorder. Neurochem Res 2004; 29: 2293—2302.
- Dai X., Lercher L.D., Patricia M. et al. The trophic role of oligodendrocytes in the basal forebrain. J Neurosci 2003; 23: 5846—5853.
- Davies D.C., Wardell A.M., Woolsey R. et al. Enlargement of the fornix in early-onset schizophrenia: a quantitative MRI study. Neurosci Let 2001; 301: 163—166.
- Davis J.M. Dose equivalent of the antipsychotic drugs. J Psychiat Res 1974; 11: 65—69.
- Davis K.L., Stewart D.G., Friedman J.I. et al. White matter changes in schizophrenia: evidence for myelin-related dysfunction. Arch Gen Psychiat 2003; 60: 443—456.
- Dracheva S., Davis K.L., Chin B. et al. Myelin-associated mRNA and protein expression deficits in the anterior cingulate cortex and hippocampus in elderly schizophrenia patients. Neurobiol Dis 2006; 21: 531—540.
- Esiri M.M., Pearson R.C.A. Perspectives from other diseases and lesions. In: The neuropathology of schizophrenia. Progress and interpretation. P.J. Harrison, G.W. Roberts (eds). Oxford: Oxford Press 2000; 257—276.
- Fields R.D. Myelination: An overlooked mechanism of synaptic plasticity? Neuroscientist 2005; 11: 528—531.
- Gallo V., Ghiani C.A. Glutamate receptors in glia: new cells, new inputs and new functions. Trends Pharmacol Sci 2000; 21: 252—258.
- Ganguli R., Brar J.S., Solomon W. et al. Altered interleukin-2 production in schizophrenia: association between clinical state and autoantibody production. Psychiat Res 1992; 44: 113—123.
- Ganguli R., Brar J.S., Chengappa K.R. et al. Mitogen-stimulated interleukin 2 production in never-medicated first episode schizophrenics—the influence of age of onset and negative symptoms. Arch Gen Psychiat 1995; 52: 668—672.
- Griffiths I.R., Klugmann M., Anderson T. et al. Axonal swellings and degeneration in mice lacking the major proteolipid of myelin. Science 1998; 280: 1610—1613.
- Ishibashi T., Dakin K.A., Stevens B. et al. Astrocytes promote myelination in response to electrical impulses. Neuron 2006; 49: 823—832.
- Harrison P.J., Eastwood S.L. Neuropathological studies of synaptic connectivity in the hippocampal formation in schizophrenia. Hippocampus 2001; 11: 508—519.
- Haydon P.G., Carmignoto G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiol Rev 2006; 86: 1009—1031.
- Ho B.-C., Milev P., O’Leary D.S. et al. Cognitive and magnetic resonance imaging brain morphometric correlates of brain-derived neurotrophic factor Val66Met gene polymorphism in patients with schizophrenia and healthy volunteers. Arch Gen Psychiat 2006; 63: 731—740.
- Hof P.R., Haroutunian V., Copland C. et al. Molecular and cellular evidence for an oligodendrocyte abnormality in schizophrenia. Neurochem Res 2002; 27: 1193—1200.
- Katsel P., Davis K.L., Haroutunian V. Variations in myelin and oligodendrocyte-related gene expression across multiple brain regions in schizophrenia: a gene ontology study. Schizophr Res 2005; 79: 157—173.
- Kubicki M., Park H., Westin C.F. et al. DTI and MTR abnormalities in schizophrenia: analysis of white matter integrity. Neuroimage 2005; 26: 1109—1118.
- Kuroki N., Kubicki M., Nestor P.G. et al. Fornix integrity and hippocampal volume in male schizophrenic patients. Biol Psychiat 2006; 60: 22—31.
- Law A.J., Weickert C.S., Hyde T.M. et al. Reduced spinophilin but not microtubule-associated protein 2 expression in the hippocampal formation in schizophrenia and mood disorders: molecular evidence for a pathology of dendritic spines. Am J Psychiat 2004; 161: 1848—1855.
- Law A.J., Lipska B.K., Weickert C.S. et al. Neuregulin 1 transcripts are differentially expressed in schizophrenia and regulated by 5' SNPs associated with the disease. Proc Natl Acad Sci USA 2006; 103: 6747—6752.
- Lim C., Mufson E.J., Kordower J.H. et al. Connections of the hippocampal formation in humans: II. The endfolial fiber pathway. J Comp Neurol 1997; 385: 352—371.
- Markham J., Greenough W.T. Experience-driven brain plasticity: beyond the synapse. Neuron Glia Biol 2004; 1: 351—363.
- Miyakawa T., Sumiyoshi S., Deshimaru M.H. et al. Electron microscopic study on schizophrenia. Mechanism of pathological changes. Acta Neuropathologica 1972; 20: 67—77.
- Nelson M.D., Saykin A.J., Flashman L.A. et al. Hippocampal volume reduction in schizophrenia as assessed by magnetic resonance imaging. A meta-analytic study. Arch Gen Psychiat 1998; 55: 433—440.
- Olypher A.V., Klement D., Fenton A.A. Cognitive disorganization in hippocampus: a physiological model of the disorganization in psychosis. J Neurosci 2006; 26: 158—168.
- Qi Y., Dal Canto M.C. Effect of Theiler’s murine encephalomyelitis virus and cytokines on cultured oligodendrocytes and astrocytes. J Neurosci Res 1996; 45: 364—374.
- Peters A., Palay S., Webster H. de F. The Fine Structure of the Nervous System: the Neuron and the Supporting Cells. Oxford, UK: Oxford Univ Press 1991.
- Peters A., Sethares C. Aging and the myelinated fibersin prefrontal cortex and corpus callosum of the monkey. J Compar Neurol 2002; 442: 277—291.
- Sбnchez-Gуmez M.V., Alberdi E., Ibarretxe G. et al. Caspase-dependent and caspase-independent oligodendrocyte death mediated by AMPA and kainate receptors. J Neurosci 2003; 23: 9519—9528.
- Schmithorst V.J., Wilke M., Dardzinski B.J. et al. Cognitive functions correlate with white matter architecture in normal pediatric population: a diffusion tensor MRI study. Hum Brain Mapp 2005; 26: 139—147.
- Senitz D., Winkelmann E. Morphology of the orbitofrontal cortex in persons schizophrenic psychotics. A Golgi and electron microscopy study. Psychiat Neurol Med Psychol 1981; 33: 1—9.
- Spiegel I., Peles E. A new player in CNS myelination. Neuron 2006; 49: 777—778.
- Tekkok S.B., Goldberg M.P. AMPA?kainate receptor activation mediates hypoxic oligodendrocyte death and axonal injury in cerebral white matter. J Neurosci 2001; 21: 4237—4248.
- Uranova N.A., Zimina I.S., Vikhreva O.V. et al. Morphometric study of ultrastructural alterations of myelinated fibers in post-mortem schizophrenic brains. Schizophr Res 1999; 36: 85.
- Uranova N., Orlovskaya D., Vikhreva O. et al. Electron microscopic study of oligodendroglia in severe mental illness. Brain Res. Bull 2001; 5: 597—610.
- Uranova N.A., Vostrikov V.M., Orlovskaya D.D. et al. Oligodendroglial density in the prefrontal cortex area 9 in schizophrenia and mood disorders: A study of brain collection from the Stanley Foundation Neuropathology Consortium. Schizophr Res 2004; 67: 269—275.
- Weinberger D.R. Cell biology of the hippocampal formation in schizophrenia. Biol Psychiat 1999; 45: 395—402.
- Yang Z.W., Chengappa K.N., Shurin G. et al. An association between anti-hippocampal antibody concentration and lymphocyte production of IL-2 in patients with schizophrenia. Psychol Med 1994; 24: 449—455.
- Zaidel D.W., Esiri M.M., Harrison P.J. Size, shape, and orientation of neurons in the left and right hippocampus: investigation of normal asymmetries and alterations in schizophrenia. Am J Psychiat 1997; 154: 812—818.
- Zhang Y., Taveggia C., Melendez-Vasquez C. et al. Interleukin-11 potentiates oligodendrocyte survival and maturation, and myelin formation. J Neurosci 2006; 26: 12174—12185.
|